Hersteller Guter Preis Ammoniumchlorid CAS:12125-02-9
Synonyme
Ammonium chloratum; Ammonium Chloridum; Ammoniummuriat; Salzammoniak; Salmiak
Anwendungen von Ammoniumchlorid
Ammoniumchlorid (Industriequalität) Ammoniumchlorid (auch bekannt als „Chloramin“, auch bekannt als Halogensand, chemische Formel: NH₄Cl) ist ein farbloser kubischer Kristall oder ein weißes kristallines Pulver. Es schmeckt salzig und leicht bitter und gehört zu den sauren Salzen. Seine relative Dichte beträgt 1,527. Es ist löslich in Wasser, Ethanol und flüssigem Ammoniak, jedoch unlöslich in Aceton und Ether. Die wässrige Lösung ist schwach sauer und ihr Säuregehalt nimmt beim Erhitzen zu. Bei Erhitzen auf 100 °C beginnt es sich stark zu verflüchtigen. Bei Erhitzen auf 337,8 °C dissoziiert es in Ammoniak und Chlorwasserstoff. Bei Kälte rekombinieren diese sich wieder und bilden kleine Ammoniumchloridpartikel und weißen Rauch, der schwer absinkt und sich nur sehr schwer in Wasser löst. Bei Erhitzen auf 350 °C sublimiert es und bei 520 °C siedet es. Es nimmt wenig Feuchtigkeit auf und kann bei nassem Regen verklumpen. Es wirkt korrosiv auf Eisenmetalle und andere Metalle, insbesondere auf Kupfer, jedoch nicht auf Roheisen. Ammoniumchlorid kann durch die Neutralisationsreaktion von Ammoniak und Chlorwasserstoff oder Ammoniak und Salzsäure gewonnen werden (Reaktionsgleichung: NH3 + HCl → NH4Cl). Beim Erhitzen zersetzt es sich in Chlorwasserstoff und Ammoniak (Reaktionsgleichung: NH4Cl → NH3 + HCl). Die Reaktion verläuft nur dann nach rechts, wenn der Behälter ein offenes System ist.
Ammoniumchlorid wird hauptsächlich für Trockenbatterien, Akkumulatoren, Ammoniumsalze, Gerbereien, Galvanik, Medizin, Fotografie, Elektroden, Klebstoffe usw. verwendet. Ammoniumchlorid ist auch ein verfügbarer Stickstoffdünger mit einem Stickstoffgehalt von 24 bis 25 %. Es ist ein physiologischer, saurer Dünger und eignet sich für Weizen, Reis, Mais, Raps und andere Nutzpflanzen. Es verbessert die Faserfestigkeit und -spannung und verbessert die Qualität, insbesondere bei Baumwolle und Leinen. Aufgrund der Eigenschaften von Ammoniumchlorid kann eine unsachgemäße Anwendung jedoch negative Auswirkungen auf Boden und Pflanzen haben.
Technische Bedingungen: Umsetzung des nationalen Standards GB-2946-82 der Volksrepublik China.
1. Aussehen: weißer Kristall
2. Ammoniumchloridgehalt (Trockenbasis) ≥ 99,3 %
3. Feuchtigkeitsgehalt ≤1,0 %
4. Natriumchloridgehalt (Trockenbasis) ≤0,2 %
5. Eisengehalt ≤0,001 %
6. Schwermetallgehalt (in Bezug auf Pb) ≤0,0005 %
7. Wasserunlöslicher Gehalt ≤0,02 %
8. Sulfatgehalt (bezogen auf SO42-) ≤0,02 %
9. pH: 4,2-5,8
Ammoniumchlorid wird als Verdickungsmittel und Zusatzstoff in alkoholfreien Gesichtswassern verwendet. Laut Kosmetikherstellern sorgt die Ammoniumkomponente für das prickelnde oder stechende Gefühl, das manche Menschen mit Gesichtswassern oder Aftershaves assoziieren und das bei herkömmlichen Gesichtswassern meist durch den Alkoholgehalt verursacht wird. Die Verwendung von Ammoniumchlorid ist auf die bevorzugte Haptik der Formulierung zurückzuführen.
Ammoniumchlorid ist ein Teigverbesserer und Hefenahrungsmittel, das als farblose Kristalle oder weißes kristallines Pulver vorliegt. Etwa 30–38 g lösen sich bei 25 °C in Wasser auf. Der pH-Wert einer 1%igen Lösung bei 25 °C beträgt 5,2. Es wird als Teigfestiger und Geschmacksverstärker in Backwaren und als Stickstoffquelle für die Hefegärung verwendet. Es wird auch in Gewürzen und Relishes verwendet. Eine andere Bezeichnung für das Salz ist Ammoniumchlorid.
Weiße Kristalle, die durch die Einwirkung von Ammoniaksalzen auf Salzsäure und anschließende Kristallisation entstehen. Ammoniumchlorid ist auch als Salmiak bekannt. Wasser- und alkohollösliches Ammoniumchlorid wurde als Halogenid in vielen Verfahren eingesetzt, unter anderem bei der Herstellung von Salzpapier, Albuminpapier, Albumin-Opaltypie und Gelatineemulsion.



Spezifikation von Ammoniumchlorid
| ARTIKEL |
|
| Aussehen | Weiß kristallin |
| Ammoniumchloridgehalt | ≥99,6 |
| Feuchtigkeit | ≤0,7 |
| Zündrückstände | ≤0,3 |
| Ferrum-Gehalt | ≤0,007 |
| Metall | ≤0,0003 |
| Sulfat | ≤0,015 |
| PH (200 /123℃ | 4,0-5,8 |
Verpackung von Ammoniumchlorid


25 kg/Beutel Ammoniumchlorid
Die Lagerung sollte kühl, trocken und belüftet erfolgen.

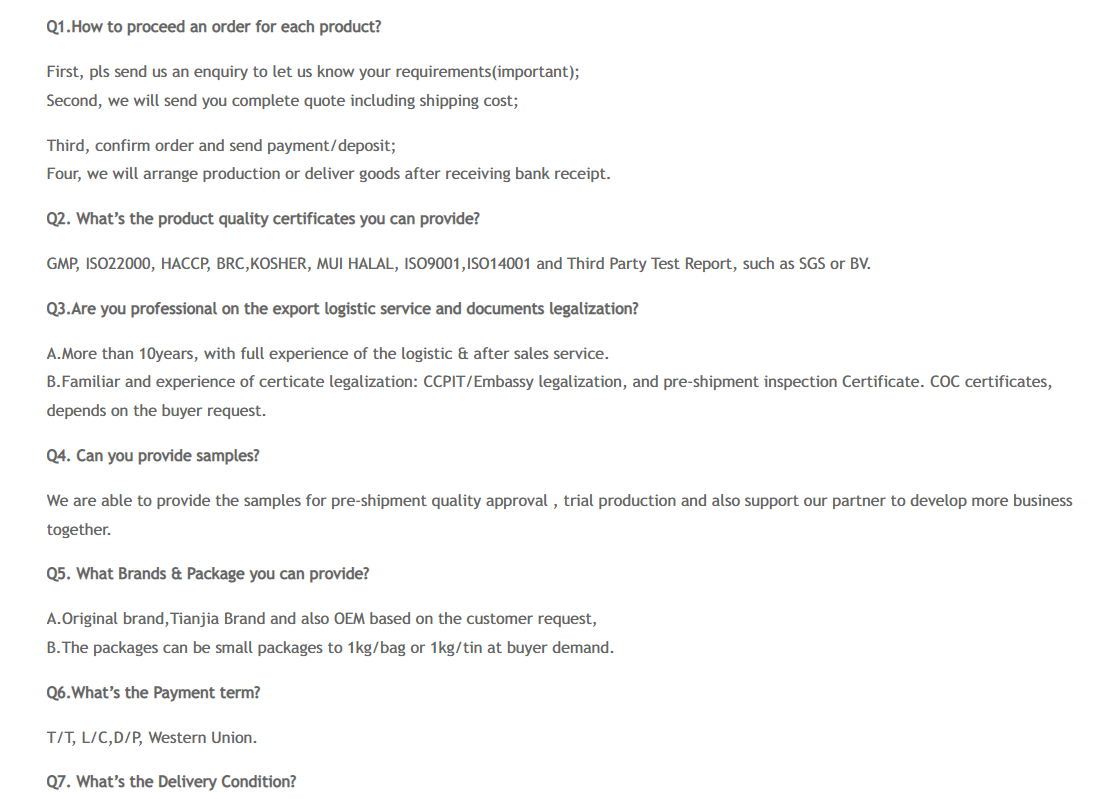
Häufig gestellte Fragen